高分辨率实时成像揭示流感病毒入侵细胞时的景象
来自瑞士和日本的科研团队近日首次以高时空分辨率,记录下流感病毒在活体人类细胞表面移动并进入细胞的全过程,为揭示病毒感染初始阶段提供了前所未有的细节视角。 研究显示,宿主细胞并非被动挨打的对象,而是在病毒靠近时出现主动伸展、推拉等动态反应,病毒与细胞之间更像是一场精密配合的“入侵之舞”。
流感感染通常始于含有病毒的飞沫进入人体,病毒附着在呼吸道上皮等细胞表面并完成入侵。此次合作团队以培养的人体细胞为模型,开发出一种专门的显微成像技术,可在放大视野下持续观察细胞表面的超微结构动态,从而第一次“现场直播”流感病毒进入活细胞的完整过程。 课题由苏黎世联邦理工学院(ETH Zurich)分子医学教授山内洋平(Yohei Yamauchi)领衔,他形容病毒侵入“就像病毒与细胞之间的一段舞蹈”,细胞会主动向病毒方向“伸手”,并参与其被包裹和内吞的全过程。
研究发现,尽管从结果看这一过程只会帮助病毒完成感染,但病毒事实上是劫持了细胞本来用于摄取激素、胆固醇、铁等必需分子的常规内吞通路。 流感病毒首先需与细胞表面的特定分子结合,然后沿着细胞膜“滑行”,在膜面上从一个位置移动到另一个位置,直至找到表面受体高度聚集的区域,那里成为其最有效的“入侵入口”。 当受体识别到病毒并完成聚集后,细胞膜会形成一个逐渐凹陷的小坑,一种名为网格蛋白(clathrin)的结构蛋白参与塑形和支撑,让这一小坑不断加深,最终像兜一样将病毒整个包裹形成囊泡。 随后,这一囊泡被牵引进入细胞内部,其表面包被逐步解体,病毒得以在细胞内释放,开启下一阶段复制过程。
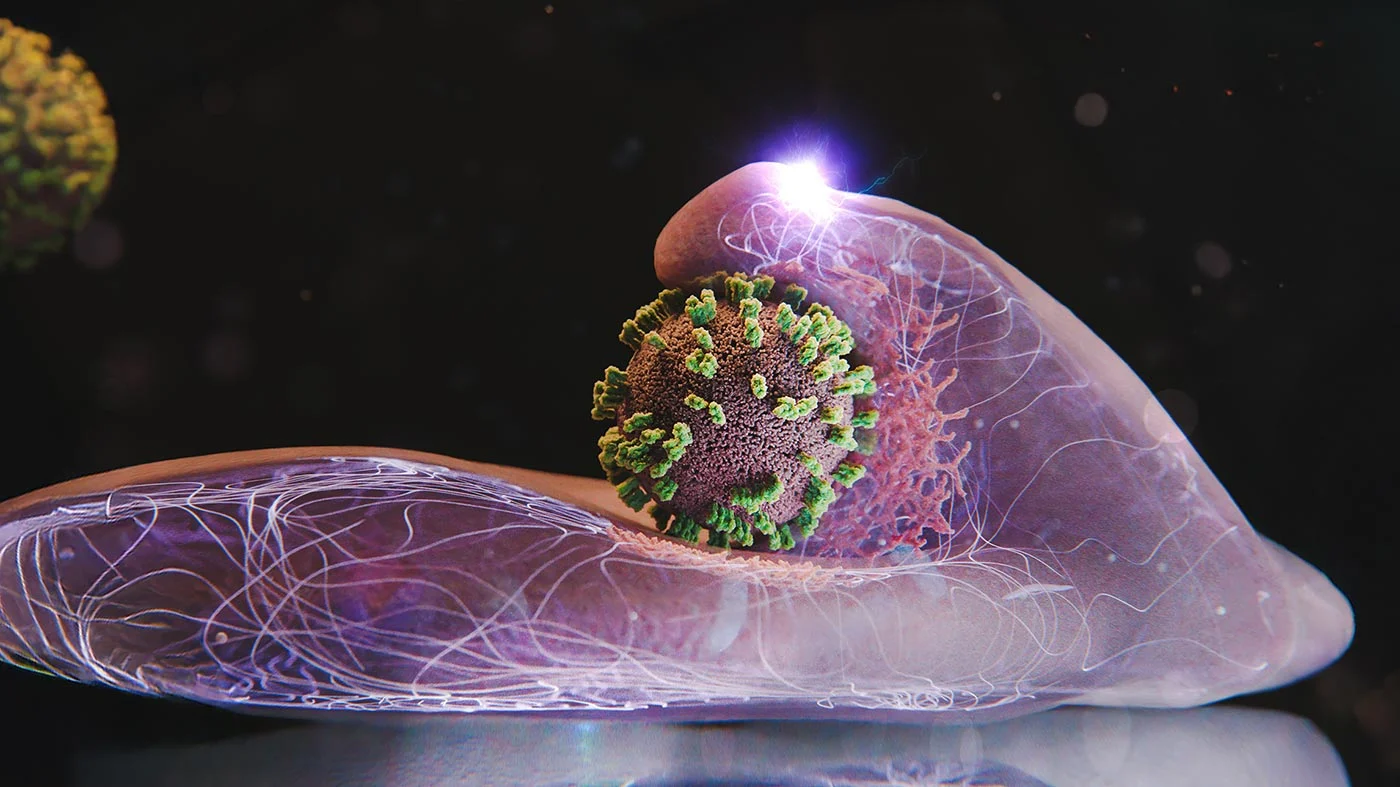
过去,科研人员尝试利用电子显微镜捕捉这一关键环节,但这类技术需要固定和破坏细胞,只能获得静态“快照”,难以还原动态过程。 荧光显微镜虽然能在活细胞中成像,却受限于空间分辨率,无法呈现细胞膜凹陷、蛋白聚集等精细结构细节。 为突破这些瓶颈,团队开发了一种将原子力显微镜(AFM)与共聚焦荧光显微镜相结合的新方法,命名为“病毒可视双模共聚焦-原子力显微技术”(ViViD-AFM)。 该技术一方面利用原子力显微镜在纳米尺度描绘细胞表面形貌,另一方面通过荧光信号标记病毒及相关蛋白位置,实现结构与功能的同步追踪。
借助 ViViD-AFM,研究人员观察到,细胞在多个层面主动“配合”病毒完成入侵:例如,它们会将网格蛋白精准招募到病毒所在位置,帮助形成包裹病毒的膜性囊泡。 当病毒略微远离细胞表面时,细胞膜还会向上“抬起”,产生明显的形变和动态运动,以重新接近和捕获病毒,这些运动在病毒稍有偏离时反而更为剧烈。 这说明流感病毒极大程度上借用了细胞自身高度调控的物质摄取系统,把原本用于维持生命活动的机制“逆用”为感染通路。
研究团队指出,这一新成像平台对于抗病毒药物开发具有重要意义,因为它可以在活细胞体系中实时观察候选药物对病毒入侵各步骤的具体影响,从而更有针对性地筛选和优化抑制策略。 此外,ViViD-AFM 并不局限于流感病毒,未来还可用于研究其他病毒甚至疫苗颗粒与细胞的相互作用,有望在感染早期阶段提供更全面的物理和生物学线索,为新型抗病毒疗法和预防手段的设计提供实验基础。